HTML
-
喇曼光谱(Raman spectra, RS)是一种散射光谱,对入射光频率不同的散射光进行分析, 得到物质分子振动转动信息从而分析物质的组成,因其具有测试时间短、灵敏度高、绿色环保等优点[1],近年来被广泛地应用到食品、生物、医疗等领域的成分分析研究中。但液体的常规喇曼光谱往往效果不佳,荧光干扰较强。表面增强喇曼光谱散射(surface-enhanced Raman scattering, SERS)具有增强振动信号、低检测限以及良好的吸附选择性等优点, 在研究分子间相互作用,分子结构以及表征表面分子吸附行为等方面均有重要的作用,其检测水准可以达到单分子级别, 解决了常规喇曼灵敏度不够的问题,可以获得常规喇曼光谱实验难以得到的物质结构信息[2-4],在定性分析物质成分结构的过程中有很大优势,为无损鉴别提供了可能。因此在众多领域的应用分析上具有良好的发展潜力[5-15]。
在关于SERS的增强机理中,已提出的理论模型可分为电磁场增强和化学增强两种。电磁场增强机理是基于局域表面等离子体激元共振效应,而化学增强机理是以电荷转移理论为基础。电磁场增强机理起主导作用,而化学增强机理主要强调的是吸附分子与金属之间的化学吸附,它主要依赖于吸附分子的吸附位、吸附分子的能级等。虽然化学增强的效果很小,但却对SERS效应有显著的影响。表面增强喇曼散射的增强基底目前有很多种类,对于不同性质的检测样品,基底的增强特性也不一而同。利用SERS技术确定样品成分的前提就是寻求一个适合的表面增强基底。本实验中采用的银胶纳米颗粒溶液与TiO2-AgNPs薄膜两种SERS基底中银纳米粒子的吸附程度不同,这会导致在银纳米粒子表面附近的入射光场和喇曼散射光场的增强不同,这正是作者选择银胶纳米颗粒溶液与TiO2-AgNPs薄膜两种SERS基底进行比较的原因[16]。
近年来, 随着人们对中医疗效的广泛认可,中医药研究在不断深入。中药成分、计量往往难以实现标准化、精确化,这在很多方面限制了中医药的发展。因此,如何精确鉴定中药成分对中医药的发展具有十分重要的意义。中药溶液成分非常复杂而且浓度一般较低,常规喇曼光谱在分析溶液成分时往往无法达到理想效果,只有通过SERS技术才可能更加精准地鉴别有效成分,进而精确使用剂量。目前分析溶液时比较有效的增强基底分为金属电极、金属溶胶、金属沉积岛膜与自制薄膜等几大类[17-20]。
附子(aconiti lateralis radix praeparata, ALRP)是毛茛科植物乌头的子根的加工品,辛、甘,大热,有毒。归心、肾、脾三经,有散风祛湿止痛等作用。附子中的主要有效成分是乌头类生物碱。一方面,附子是回阳救逆中药之首选,被誉为“药中良将”、“药中四维”,在临床抢救危急重症时的作用显著;而另一方面,附子因其容易导致毒的副作用,在临床时须慎用。迄今,因服用附子发生中毒反应的案例很多,然而临床应用还没有实用指南对其进行安全性监控,目前临床观测附子毒副反应的项目其标准既不系统,也不明确。
实验中主要采用倒置显微RENISHAW(INVIA)喇曼光谱仪,配置德国Zeiss Axiovert25倒置显微镜为实验仪器,将中药附子溶液样品,分别以TiO2-AgNPs薄膜和银胶纳米颗粒溶液作为SERS基底进行了多组实验得出附子的表面增强喇曼光谱。并对比了两种基底对样品喇曼光谱的增强作用,分析了各自的优劣性,对其它中药溶液使用SERS增强喇曼光谱对其有效成分的分析和研究具有一定的参考意义。
-
取附子原药材,洗净并以60℃的温度烘干,捣碎;称取烘干后的附子粉末100g加入水500mL,煎煮30min;取溶液的上清液,置于温度为4℃的冰箱内保存备用。
-
倒置显微RENISHAW(INVIA)喇曼光谱仪,配置德国Zeiss Axiovert 25倒置显微镜,分辨率为2cm-1;双瑞利光学滤光片;气冷式CCD阵列探测器;光栅尺度为1800line/mm;狭缝宽度为20μm;光源为He-Ne激光器,激光波长为532.4nm,632.8nm两种,本实验中采用的激光波长为632.8nm,激光的最大输出功率为35mW。
电子分析天平(QS104)、JJ-1精密增力定时可调速电动搅拌机、磁力加热搅拌器(CJJ-781)、离心机、震荡仪、高温炉(FURNACE1200℃)、镀膜提拉机(ZR-4200)、美的家用微波炉、超声波振荡器(KQ118)。
-
硝酸银、柠檬酸三钠、钛酸丁酯、乙酰丙酮、丙酮、聚乙烯吡咯烷酮(polyethylene pyrrolidone, PVP)、硝酸、去离子水、载玻片、层析滤纸,以上所有试剂均为分析纯;一份附子溶液样品,由大连医科大学附属妇产医院提供。
-
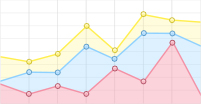
本实验中采用水热法(hydrothermal, HT)制备银纳米粒子[21]:将0.5g PVP溶解于10mL去离子水中制成溶液,然后依次将5mL浓度为0.1mol/L的NaOH水溶液和5mL浓度为0.2mol/L的葡萄糖水溶液加入到制备好的PVP溶液中,搅拌5min使其均匀分散。在分散过程完成后逐滴加入10mL浓度为0.5mol/L的AgNO3水溶液。随着AgNO3水溶液的逐滴加入,发现混合溶液的颜色逐渐向黑色转变,这意味着此过程中有氧化银形成。当AgNO3溶液完全加入后继续搅拌10min,然后把反应后的溶液全部移入50mL的内衬聚四氟乙烯的反应釜中,并在70℃的温度下保持20min~360min。待反应完全结束后,取出反应釜冷却至室温。将反应釜中生成的银胶溶液取出后放入离心机以8000r/min的转速对获得样品进行离心处理10min,然后用去离子水冲洗。以上的离心和冲洗过程共进行4次,最终将获得的银纳米粒子贮存在水环境中。制备好的银胶纳米粒子溶液过24h后使用。对银胶溶液进行喇曼光谱定标后调整激光功率,进行喇曼光谱检测,实验结果如图 1所示。
-
第1步:制备TiO2薄膜。(1)50mL钛酸丁酯和30mL乙酰丙酮混合在一起,搅拌10min,形成溶液A;(2)110mL乙醇溶液,1.4mL去离子水,0.2mL硝酸混合搅拌10min,形成溶液B; (3)在搅拌过程中,将溶液B逐滴加入到溶液A中,将混合溶液搅拌30min,形成TiO2溶胶; (4)TiO2薄膜通过浸渍的方法沉积在玻璃基板上,通过调整镀膜提拉机的提拉速度来控制形成TiO2薄膜的厚度,最后在450℃的温度下煅烧1h样品,形成TiO2薄膜。
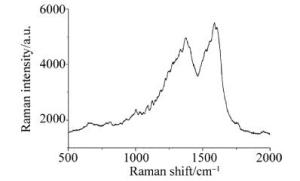
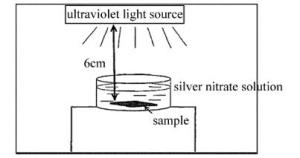
第2步:TiO2薄膜上用光催化方法生长AgNPs薄膜。将覆盖有TiO2薄膜的玻璃基板放在浓度为3mmol/L的AgNO3溶液中,用紫外光照射,催化AgNP3的沉积。紫外灯和基板距离6cm,照射时间为60min(如图 2所示)。将带有AgNPs膜的TiO2薄膜样品,进行喇曼光谱检测,实验结果如图 3所示。
-
关于基地的表征分析,本文中参考借鉴了之前项目团队的研究结论[21],利用紫外可见吸收光谱仪(HP8453, USA)、原子力显微镜(Agilent, Santa Clara, CA)、透射电镜(JEM.2000EX)、扫描电镜(Nova NanoSEM 450, FEI)、喇曼光谱仪(Renishaw Gloucetershire UK)、X射线光电子能谱仪(EscaLab 250, Thermo VG, USA)和紫外可见吸收光谱仪(OceanMaya2000-Pro, USA)对合成的银胶纳米粒子与TiO2-AgNPs薄膜样品分别进行了表征。所有的喇曼测试实验条件均相同,条件如下:选用波长为632.8nm、功率为3.28mW的He-Ne激光作为激励光源,扫描积分时间为10s。
-
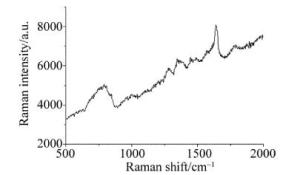
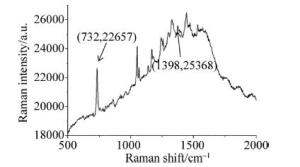
(1) 附子溶液样品与衬底融合:将银胶纳米粒子溶液与附子溶液按1:1比例混合后振荡20min取出,吸入毛细管中;(2)喇曼光谱定标后,根据实验的具体情况选择激光功率为10%,调整激光功率(银胶纳米颗粒溶液作为基底时,激光功率小于10%时增强效果不明显,无法获得清晰的喇曼光谱),对多组加入基底的附子溶液样品进行喇曼光谱检测,获取其喇曼散射光谱;(3)选取其中10组样品的SERS进行对比,其中最具有代表性的SERS如图 4所示。
-
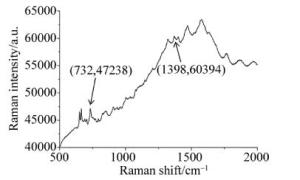
将附子样品溶液滴到基板不同位置上,待水分挥发后,根据实验具体情况选择激光功率,调节激光功率为1%(TiO2-AgNPs薄膜作为基底时,激光功率高于1%时散射会发生溢出现象,无法获取完整的光谱), 选取基板上5个样品沉积良好的测试点进行喇曼光谱检测,分析得出最具代表性的SERS如图 5所示。
1.1. 制备中药附子水提纯样品
1.2. 试剂与样品
1.2.1. 实验仪器
1.2.2. 实验试剂及样品
1.3. 银胶纳米颗粒溶液与TiO2-AgNPs薄膜的SERS基底的制备
1.3.1. 纳米银胶制备
1.3.2. TiO2-AgNPs的制备
1.4. 表征与分析
1.5. 附子溶液的银纳米粒子与TiO2-AgNPs薄膜的SERS基底表面增强喇曼光谱检测
1.5.1. 利用银胶纳米粒子溶液作为SERS基底对附子溶液样品进行喇曼检测
1.5.2. 利用TiO2-AgNPs薄膜作为SERS基底对附子溶液样品进行喇曼检测
-
首先,本实验中采用的两种基底对附子溶液样品均有增强作用,都出现了附子成分的特征峰,证明了本实验中采用的两种SERS基底都可以对样品进行增强。由于纯基底本身也存在着喇曼光谱,具有一定的峰强,所以SERS基底的增强效果主要体现在特征峰峰强I的增量ΔI上,其值等于SERS谱的峰强减去纯基底峰强。
其次,本实验中根据两种基底的不同特性,采用了不同的激光功率:TiO2-AgNPs薄膜采用的激光功率为1%,银胶纳米颗粒溶液采用的激光功率为10%。喇曼光谱的特征峰强可近似与激光功率的平方成正比[16]。已知两种基底采用的激光功率比值的平方为:
这说明两种不同基底所得的SERS中,同一喇曼位移处的峰强若相同,则TiO2-AgNPs薄膜基底的增强敏感度为银胶纳米颗粒溶液的100倍。
由于不同的基底具有不同的荧光干扰强度,所以本文中通过比较同一基底的SERS中的不同喇曼位移的相对峰强比,来定性地分析两种基底的增强效果。
在附子溶液样品以TiO2-AgNPs薄膜基底与银胶纳米颗粒溶液基底进行表面增强所获取的喇曼光谱中,选取一个喇曼位移为732cm-1的特征峰作为基准,其特征峰峰强Is分别为47238和22657,再选取一个喇曼位移1398cm-1(此处为葡萄糖/葡萄糖醛酸化学键的喇曼位移)的特征峰作为对比峰,峰强In分别为60394和25368。带入(2)式中计算可得喇曼位移1398cm-1的相对峰强比,TiO2-AgNPs薄膜基底为27.85%;银胶纳米颗粒溶液基底为11.97%。
通过上述两个方面可以定性地分析出:TiO2-AgNPs薄膜作为SERS基底在本实验中对中药成分附子的增强效果更为明显,这与在血清溶液中的实验结果相同[16]。
-
在相同的测试条件下,TiO2-AgNPs薄膜基底的测试手段更加容易。然而TiO2-AgNPs薄膜基底的制备过程复杂,且容易氧化、稳定性差,加之中药样品中成分的腐蚀和氧化作用更明显,导致基底的可用时间非常短。因此,TiO2-AgNPs薄膜基底更适合于高精度、小数量的中药溶液样品成分鉴定。
银纳米溶胶溶液基底在实验中需要吸入玻璃毛细管中进行喇曼散射,要寻找适合的银胶汇聚点进行对焦,对实验者操作的技巧要求较高。但银纳米溶胶溶液基底的制备相对较容易,具有稳定性高、易于保存、不容易氧化变质等优点。如果储存适当可用时间相对较长,制备一次可以用于大量样品的多次测量。虽然银纳米溶胶溶液基底的增强效果弱于TiO2-AgNPs薄膜基底,但其增强效果已经十分明显,可以满足一般情况的成分确定。因此,其更适于易氧化、数量大的中药溶液样品成分鉴定。
由实验可知,对于中药溶液样品,可根据实验的不同要求选择不同的SERS基底获取表面增强喇曼散射光谱,确定样品成分。
2.1. 两种SERS基底对中药附子溶液中成分的增强敏感度对比
2.2. 两种SERS基底的制作和应用
-
通过对同一样品,中药附子溶液,采用不同的基底进行多组喇曼散射增强,得到两种SERS。分析对比后得出:银胶纳米颗粒溶液与TiO2-AgNPs薄膜均对样品起到了一定的增强作用,样品的喇曼特征峰的数量增加,峰强加大,从而使获取中药溶液的喇曼散射光谱成为可能;TiO2-AgNPs薄膜基底的增强敏感度远远高于银胶纳米颗粒溶液基底,但其具有制备复杂、稳定性差和容易氧化等缺点,更适合于高精度、小数量的中药溶液样品成分确定;银胶纳米颗粒溶液基底增强敏感度弱于TiO2-AgNPs薄膜基底,且实验复杂性高,但其具有制备简单、使用周期长、抗氧化性强和氧化稳定性高等优点,在检测易氧化、数量大的中药溶液样品时具有一定优势。
本文中对两种SERS基底的研究,为今后利用表面增强喇曼技术检测不同中药溶液样品有效成分,进而使中药使用更加信息化明确化具有一定的参考价值。
由于现阶段试样样品数量有限,尚未对其它中药样品进行相关检测。下一阶段的主要研究方向就是选取更多种类的中药样品进行实验,进一步明确两种基底对中药成分检测的优劣性,并且要研究出对中药样品的浓度会对基底的增强效果产生何种影响。

 Map
Map


 DownLoad:
DownLoad:



