-
光声成像技术(photoacoustic imaging)是指利用目标受短脉冲激光照射产生的超声波进行成像的技术。其很好地结合了光学和超声这两种成像技术的优点:一方面,由于光声成像是利用超声信号进行接收成像,所以其探测深度较光学成像要深;另一方面,由于光声成像是利用组织吸收光谱的不同成像,因此其图像对比度较超声成像要好[1]。近年来,光声成像技术发展迅猛,各种相关成像检测技术和方法不断涌现,如光声层析成像(photoacoustic tomography, PAT)[2-3]、光声显微成像(photoacoustic microscopy,PAM)[4]、光声光谱成像(photoacoustic spectroscopy, PAS)[5-9]、光声多普勒(photoacoustic Doppler, PD)[10]等。而且光声成像也展现出了极好的兼容性,由于其使用超声探头接收信号,极易与传统超声成像相结合,进行多模式和多尺度成像。如将光声成像与血管内超声成像技术相结合的血管内光声成像技术(intravascular photoacoustic imaging,IVPA)[11-12]与光学相干断层扫描(optical coherence tomography, OCT)技术结合实现高分辨率结构和功能成像[13],与核磁共振成像(magnetic resonance imaging, MRI)、喇曼成像结合进行多模式脑肿瘤分子成像[14]等。因此,光声成像正越来越多地被应用于生物医学的各个领域,如光声成像技术应用于乳腺癌及黑色素瘤光声成像检测[15-16]、肿瘤血管再生成像[17]、血红蛋白浓度和血氧饱和度监测[18]、血管内易损斑块识别[19]、前哨淋巴结(sentinel lymph nodes, SLN)鉴别[20]、结合吲哚菁绿(indocyanine green,ICG)、纳米颗粒等造影剂进行分子影像[21]等。因此,光声成像技术在分析生物组的结构形态、代谢功能、生理/病理特征等方面都具有广泛的研究价值和临床应用前景。
目前,国内外已有大量的文献中总结综述了光声成像技术的研究进展及其在生物医学等方面的应用[22-28],但还少有专门分析光声成像的激励光源的研究。光声激励光源作为光声成像的核心部件,其性能很大程度地决定了一套光声成像系统的性能,而不同的光声成像系统根据其作用和目的的不同,也需选择不同特性的激光作为其光声激励的光源。如激光的波长决定了光声成像的工作波长,针对不同吸收特性的目标需使用不同波长的激励脉冲激光,以达到最佳的功能检测效果;而多光谱光声成像则必须要有多个不同波长的脉冲激光分别进行扫描成像。因此,本文中重点分析了光声成像对光源的限制和要求,总结了不同种类光声光源的现状和各自优劣,意为光声成像技术研究和光声成像产品研制中对光声光源的选择提供相应的参考和帮助。
-
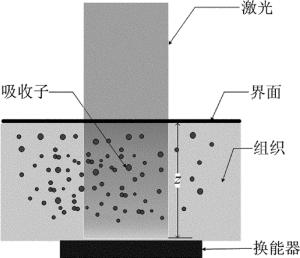
根据光声效应,光声成像的原理如图 1所示。当使用短脉冲激光照射生物组织时,入射激光的能量会被组织中的吸收子(如血细胞、血红蛋白、黑色素等)吸收并转换为热能,从而导致组织产生瞬时热弹性膨胀并挤压周围组织从而产生超声信号,用超声换能器接收该光声信号,经扫描后最终成像。
光声信号强度与入射光脉冲强度和观测对象的光吸收系数成正比:
$ {P_0}\left( z \right) = \mathit{\Gamma }{\mu _{\rm{a}}}{F_0}{\rm{exp}}( - {\mu _0}z) $
(1) 式中, P0(z)为光声信号的强度,μa是光吸收系数,F0是入射光波强度,μ0为超声衰减系数,z为传播距离,Γ为比例常数。
-
根据光声成像的原理,对其激励光源的要求主要为热限制τth和压力限制τs[28-29]:
$ \left\{ \begin{array}{l} {\tau _{{\rm{th}}}} \approx {L_{\rm{p}}}^2/(4{D_{\rm{t}}})\\ {\tau _{\rm{s}}} = {L_{\rm{p}}}/c \end{array} \right. $
(2) 式中,Lp是组织吸收结构的尺寸,Dt是热扩散系数,c是超声波在组织中的传播速度。通常软组织的Dt=1.4×10-3cm2/s,c=1540m/s,设Lp=150μm,则根据公式可得:τth=40.2ms,τs=97.4ns。可见,热限制τth要求光声光源脉宽必须小于40.2ms,一般脉冲光源都能符合;而压力限制τs则要求光源脉宽小于97.4ns,这就决定了光声激励光源的脉宽要小于97.4ns。如此,光源的脉冲持续时间就会比组织吸收体的热扩散和压力扩散的时间还要小,进而在光声成像中热扩散和压力扩散的影响便可忽略[30]。因此,目前光声成像中应用的多为脉宽小于100ns的短脉冲激光器。
-
由(1)式可知,为了获得更高的光声信号,激光的入射功率或光强应越大越好。但考虑其对探测目标尤其是生物组织的伤害,因此对于光声激励光源功率或光强的要求主要是基于安全考虑。以美国国家标准(American National Standard Z136.1-2000)定义的生物组织最大辐射剂量(maximum permissible exposure,MPE)为例,在光声常用的可见光和近红外区域(400nm~1400nm),对皮肤组织来说,光声所使用短脉冲激光(1ns~100ns)的MPE(单位:mJ/cm2)为[31]:
$ \left\{ \begin{array}{l} 20, (400{\rm{nm}} < \mathit{\lambda } < 700{\rm{nm}})\\ 20 \times {10^{2(\lambda - 0.7)}}, (700{\rm{nm}} < \mathit{\lambda } < 1050{\rm{nm}})\\ 100, (1050{\rm{nm}} < \mathit{\lambda } < 1400{\rm{nm}}) \end{array} \right. $
(3) 因此,在进行显微光声成像等过程中,需要注意控制聚焦激光的能量密度,使其控制在组织可以接受的范围内。如果超出MPE要求,则可以使用调制激光输出能量或使用光衰减片等方法来进行控制。
-
首先,根据光声成像的原理公式(1)式可以看出,光声信号的强度除了与入射激光器的强度有关外,还与组织的光吸收系数μa成线性关系,即在同等条件下,μa越大,光声信号强度越大。因此,在光声成像时,应根据探测目标的吸收光谱,选取最为有利地强吸收峰对应波长作为光声激励的波长,以达到最佳的功能检测效果。例如常用的光声成像造影剂ICG, 由于其在血液中的吸收光谱主要在650nm~850nm范围内,因此多使用在该吸收光谱范围的波长作为其光声探测的光源,尤其是最强吸收峰的805nm。在多波长光声成像时,也应尽量选取多个吸收光谱峰值波长作为成像的波长。
同时,由于光波的特性(如频率、波长、能量密度等)、生物组织结构及其生物物理化学的多样性导致光与生物组织的相互作用十分复杂,光在组织中的穿透深度也受到较大的限制,进而限制了光声成像的探测深度。研究发现,在700nm~1400nm的近红外光波段内,生物组织对光的吸收和散射都是最小的,被称作组织光窗[32]。因此,在考虑组织吸收光谱特性的同时,应尽量选取在近红外波段内的吸收谱峰值波长来作为光声激励光源的波长,从而获得较高的探测深度。
-
脉冲式Nd:YAG激光器是目前在光声成像中使用最普遍的激励光源,广泛应用于光声显微成像、光声层析成像等。Nd:YAG是一种固体激光器,如图 2所示。主要由Nd:YAG棒(多采用钇铝石榴石晶体作为工作物质)、抽运闪光灯、谐振腔及调Q开关组成。脉冲式Nd:YAG激光器发射激光的波长为1064nm[33]。Nd:YAG可激发脉冲激光或连续式激光,而光声成像中使用的脉冲式Nd:YAG激光器通常工作在调Q开关模式[34]。
Nd:YAG激光器除了1064nm波长,也可倍频至532nm,其脉冲发射峰值能量高可达50mJ,脉宽短可达2ns~5ns,十分适合用于光声成像。在降低脉冲峰值能量的条件下,Nd:YAG激光器可获取很高的重复频率(20kHz~50kHz)[9],能够很好地满足光声实时成像的需求。相对于光学参量振荡(optical parametric oscillator,OPO)激光器来说,Nd:YAG在激光波形、稳定性以及价格方面均有较大的优势。此外,当前国内外相关产品也十分成熟和繁多,如Coherent、InnoLas、Continuum等,因此其被广泛地应用于光声成像的实验研究当中。
但另一方面,虽然Nd:YAG激光器可以通过倍频到更低的波段,但由于光声成像多用可见光和近红外波段,因此其一般不能用作多波长光声成像或光声光谱成像。其次,Nd:YAG电源和冷却系统等都体积较大,不适合进行小体积、高集成光声成像系统的应用。
-
OPO激光器是一种宽调谐相干光源,其最大的特点是能够产生从紫外到远红外的宽光谱波长可调激光。其较之固体激光器和气体激光器的优点在于具有很大的波长调谐范围、使用操作简易、可方便地设置工作的波长和输出功率、且能输出较大功率的激光。目前,比较主流的光声OPO激光器可以从可见光和近红外宽光谱范围中获得波长连续可调的输出,如美国Opotek Inc.公司专门为光声成像研制生产的PhocusTM(HE)型OPO激光器,利用一个调Q开关Nd:YAG激光器作为抽运源,可产生680nm~950nm内任意波长的脉冲激光,激光脉宽5ns,最高峰值功率可达30mJ~50mJ,重复频率10Hz。OPO激光器以其多波长可调、脉宽短和峰值能量高的特点,目前已广泛使用在光声成像的多光谱研究及相关光声成像产品中[35-37]。如图 3所示,使用680nm~900nm不同波长的脉冲激光对同一心血管成像,即可得到不同波长下的心血管光声图像,反映出心血管对不同波长光的吸收差异[38]。目前全球主要的两款光声成像产品——加拿大Visual Sonics公司生产研制的Vevo LAZR小动物光声成像系统和美国Enlight Biosciences子公司生产的Nexus-128光声成像系统均采用的是可调谐脉冲OPO激光器作为激励光源。

图 3 利用OPO激光器获取的不同波长下的心血管图像[38]
但OPO较之Nd:YAG激光器激光发散角较大、光斑质量较差,而且设备体积更大、价格昂贵,这也限制了光声成像设备的普及和应用范围。
-
半导体激光器又称激光二极管,是用半导体材料如砷化镓(GaAs)和硫化锌(ZnS)等作为工作物质的激光器。半导体激光器重量轻、体积小、寿命长、价格便宜、易与集成电路兼容集成,且可用吉赫兹的高频直接进行电流调制输出。因此,半导体激光器在光通讯、光存储、激光打印、光陀螺和光测距等方面应用十分广泛。
对光声成像而言,研究者们也尝试利用半导体激光器进行光声成像,如KOLKMAN等人利用一高功率的脉冲式半导体激光(iRLS, Laser Components GmbH, 脉宽112ns,峰值功率210W@905nm)成功获得了手部血管的光声图像[39]。但相对于传统的Nd:YAG激光器和OPO激光器,其脉冲宽度、激光峰值能量、单色性、输出功率等方面都略显不足。因此,为了将半导体激光器更好地用于光声成像,目前已有研究采用编码调制的脉冲电源来对半导体激光器进行脉冲调制,进而利用多个脉冲调制半导体激光器将输出激光进行耦合来提高系统输出光强,从而实现在较低的功率下即可获得较好的光声成像效果[40-42]。如ALLEN和BEARD利用光纤束将4个905nm的InGaAs半导体激光器发出的激光耦合到一起,并用脉冲发生器控制激光器激励电源的脉宽,从而成功得到了脉宽在50ns~500ns、重复频率在2kHz~20kHz可调的光声激励光源,如图 4所示。在此基础上,还有研究者利用多组不同工作波长的半导体激光器实现了多波长的光声成像[43]。由于半导体激光器相对Nd:YAG和OPO激光器体积小、成本低、集成度好,近年来越来越多的光声成像研究和系统采用了半导体激光器,如高分辨光声显微系统、手持式光声成像系统和便携式光声层析成像系统等[44-47]。
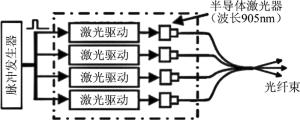
图 4 多个脉冲调制半导体激光器集成的光声光源模块[42]
-
发光二极管(light-emitting diode,LED)是一种由一个P-N结半导体构成能直接将电能转化为光能的固态半导体发光器。其与半导体激光器的区别在于LED是利用注入有源区的载流子自发辐射发光,而半导体激光器是受激辐射发光,且LED没有光学谐振腔,功耗更低、结构更简单、成本也更低廉。但LED输出光功率小、发散角度大、多为连续光输出,这导致LED以往多用于照明,而未在光声成像研究中使用。
但近两年的研究表明,随着LED发光密度、电子电路技术和微弱信号采集检测能力的日益增强,利用类似半导体激光器调制脉冲电源的方式,LED也可以获得极短的脉冲光,从而满足光声成像的需要[48-49]。其中AGANO和SATO等人对LED光声成像进入了深入的研究,例如使用多种波长的LED阵列光声成像、将LED与超声探头集成进行便携式光声成像等[49-52]。图 5中展示了一个基于4个不同波长和功率的LED组成的多波长光声显微成像系统。其中LED的波长和功率分别为660nm/10.8mW, 617nm/7.62mW, 505nm/9.82mW和455nm/16.4mW。系统采用信号发生器产生所需的脉冲激励电源驱动LED,调制的重复频率为90Hz,并利用光纤耦合系统将不同波长LED发出的光照射到被测目标上。考虑到LED激发的光声信号强度较弱,系统还采用了锁相放大器来对探测到的光声信号进行增益处理,最终成功获得了不同波长下的光声图像,并进行了光声图像的多色彩融合实验,取得了较好的实验效果。
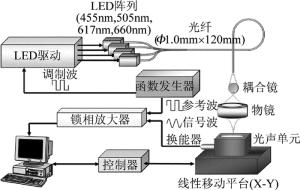
图 5 多波长LED光声成像系统原理示意图[48]
虽然目前使用LED进行光声成像的信号强度值只能达到Nd:YAG等传统固态激光器的1/40[49],但由于LED的价格十分低廉且可芯片集成,加之波长选择较多,为光声成像系统简化系统结构、降低系统功耗、增强仪器灵活性、降低设备成本等方面提供了极大的可能,具有极好的市场潜力。例如,目前已有国外厂商推出了基于LED光源集成阵列模块的光声成像系统AcousticX(PreXion Corporation,日本), 采用690nm,850nm,925nm等多组高强度的LED,脉宽最高可达30ns,重复频率1kHz,可进行128通道的光声2维成像。
-
光声成像激励光源作为光声成像的核心部件,在满足光声成像热限制和压力限制的前提下,应就系统研究观测对象和用途来进行相应的选择。选择的依据包括:根据被测目标的光谱吸收特性来选择特定波长的激励激光;根据成像方式的需要确定是单波长成像,还是双波长或多波长光声成像;根据成像帧频或观测实时性的需要,选择合适的激光器重复频率;根据系统探测的信噪比和生物安全效应,选择合适激光脉冲峰值能量。由于一般光声信号的幅值都较低,尤其高频光声信号,建议尽可能地选用高脉冲峰值能量的激光,以获取高信噪比的光声信号。
就目前光声成像激励光源的研究进展来看,Nd:YAG和OPO激光器虽然体积较大、价格昂贵,但其性能稳定、技术指标高,仍是光声实验研究和产业化的首选。但半导体激光器和LED激光器,虽然在性能上有所不足,但其体积小、集成度高、成本低,在减小光声成像设备体积,增强其灵活性和集成度,降低成本方面十分有潜力。而在未来,随着新型光源技术的涌现,以及高灵敏超声探头和系统电子电路在微弱信号检测方面能力的提高,在满足光声成像热限制和压力限制的前提下,对光源峰值功率、方向性、单色性等的要求都将进一步降低,从而使得光声成像光源有更多的选择。
光声成像激励光源的现状及选用
Status and selection of photoacoustic imaging exciting laser sources
-
摘要: 随着光声成像技术研究的迅猛发展,其越来越多地被应用于生物医学成像及检测的各个方面。由于现有光声成像产品多受限于其激励光源,导致结构复杂、体积庞大、价格昂贵,限制了其进一步普及和推广。分析了光声成像对光源的限制和要求,总结了现有Nd:YAG、光学参量振荡器、半导体激光器及发光二极管等不同种类光声光源的现状和优劣,为光声成像技术研究和光声成像产品研制中对光声光源的选择提供相应的参考和指导。Abstract: With the rapid development of photoacoustic imaging, it is increasingly used in aspects of biomedical imaging and diagnosis. The existing photoacoustic imaging products are limited to further popularization and promotion because of the excitation light sources, which lead to complex structure, large volume and high cost. The limitations and requirements of light source in photoacoustic imaging were analyzed. The present situation, advantages and disadvantages of different types of photoacoustic sources, including Nd:YAG, optical parametric oscillator, semiconductor lasers and light-emitting diode were summarized. This work should be helpful to select appropriate light source for photoacoustic imaging technology research and photoacoustic imaging product development.
-
Key words:
- lasers /
- exciting light source /
- photoacoustic imaging /
- semiconductor laser /
- LED
-
图 3 利用OPO激光器获取的不同波长下的心血管图像[38]
图 4 多个脉冲调制半导体激光器集成的光声光源模块[42]
图 5 多波长LED光声成像系统原理示意图[48]
-
[1] WANG L V.Photoacoustic imaging and spectroscopy[M].New York, USA:CRC Press, 2009:1-25. [2] WANG L V, HU S. Photoacoustic tomography:in vivo imaging from organelles to organs[J]. Science, 2012, 335(6075):1458-1462. doi: 10.1126/science.1216210 [3] WANG L V. Multiscale photoacoustic microscopy and computed tomography[J].Nature Photonics, 2009, 3(9):503-509. doi: 10.1038/nphoton.2009.157 [4] ZHANG H F, MASLOV K, STOICA G, et al. Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging[J].Nature Biotechnology, 2006, 24(7):848-851. doi: 10.1038/nbt1220 [5] ROSENCWAIG A. Photoacoustics and photoacoustic spectroscopy[M].New York, USA:Wiley Press, 1980:1-69. [6] KOSTEREV A A, BAKHIRKIN Y A, CURL R, et al. Quartz-enhanced photoacoustic spectroscopy[J].Optics Letters, 2002, 27(21):1902-1904. doi: 10.1364/OL.27.001902 [7] CAO Y F, JIAN X H, JIAO Y, et al. Comparison of time domain and frequency domain multi-wavelength photoacoustic signals[J].Laser Technology, 2016, 40(6):921-925(in Chinese). [8] SHI M K, HU B, YING H Sh, et al. Research of photoacoustic spectroscopy effect of ethylene concentration detected by laser[J]. Laser Technology, 2016, 40(3):426-431(in Chinese). [9] JIAO Y, JIAN X H, XIANG Y J, et al. Double spectrum analysis of photoacoustic signal[J].Acta Physica Sinica, 2013, 62(8):87803(in Chinese). [10] FANG H, MASLOV K, WANG L V. Photoacoustic Doppler effect from flowing small light-absorbing particles[J]. Physical Review Letters, 2007, 99(18):1845011-1845014. [11] BAI X, GONG X, HAU W, et al. Intravascular optical-resolution photoacoustic tomography with a 1.1mm diameter catheter[J].Plos One, 2014, 9(3):e92463. doi: 10.1371/journal.pone.0092463 [12] WANG B, SU J L, KARPIOUK A B, et al. Intravascular photoacoustic imaging[J].IEEE Journal Quantum Electron, 2010, 16(3):588-599. doi: 10.1109/JSTQE.2009.2037023 [13] JIAO S, XIE Z, ZHANG H F, et al. Simultaneous multimodal imaging with integrated photoacoustic microscopy and optical coherence tomography[J].Optics Letters, 2009, 34(19):2961-2963. doi: 10.1364/OL.34.002961 [14] KIRCHER M F, de la ZERDA A, JOKERST J V, et al. A brain tumor molecular imaging strategy using a new triple-modality MRI-photoacoustic-Raman nanoparticle[J].Nature Medicine, 2012, 18(5):829-834. doi: 10.1038/nm.2721 [15] MANOHAR S, VAARTJES S E, van HESPEN J C, et al. Initial results of in vivo non-invasive cancer imaging in the human breast using near-infrared photoacoustics[J].Optics Express, 2007, 15(19):12277-12285. doi: 10.1364/OE.15.012277 [16] MALLIDI S, LUKE G P, EMELIANOV S. Photoacoustic imaging in cancer detection, diagnosis, and treatment guidance[J]. Trends in Biotechnology, 2011, 29(5):213-221. doi: 10.1016/j.tibtech.2011.01.006 [17] PAN D, PRAMANIK M, SENPAN A, et al. Molecular photoacoustic imaging of angiogenesis with integrin-targeted gold nanobeacons[J].The FASEB Journal, 2011, 25(3):875-882. doi: 10.1096/fj.10-171728 [18] ZHANG H F, MASLOV K, SIVARAMAKRISHNAN M, et al. Imaging of hemoglobin oxygen saturation variations in single vessels in vivo using photoacoustic microscopy[J].Applied Physics Letters, 2007, 90(5):053901. doi: 10.1063/1.2435697 [19] WANG P, MA T, SLIPCHENKO M N, et al. High-speed intravascular photoacoustic imaging of lipid-laden atherosclerotic plaque enabled by a 2kHz barium nitrite raman laser[J].Scientific Reports, 2014, 4:6889. [20] KIM C, SONG K H, GAO F, et al. Sentinel lymph nodes and lymphatic vessels:noninvasive dual-modality in vivo mapping by using indocyanine green in rats-volumetric spectroscopic photoacoustic imaging and planar fluorescence imaging 1[J].Radiology, 2010, 255(2):442-450. doi: 10.1148/radiol.10090281 [21] de la ZERDA A, ZAVALETA C, KEREN S, et al. Carbon nanotubes as photoacoustic molecular imaging agents in living mice[J]. Nature Nanotechnology, 2008, 3(9):557-562. doi: 10.1038/nnano.2008.231 [22] XU M H, WANG L V. Photoacoustic imaging in biomedicine[J].Review of Scientific Instruments, 2006, 77(4):041101. doi: 10.1063/1.2195024 [23] COX B, LAUFER J G, ARRIDGE S R, et al. Quantitative spectroscopic photoacoustic imaging:a review[J]. Journal of Biomedical Optics, 2012, 17(6):061202. doi: 10.1117/1.JBO.17.6.061202 [24] BEARD P. Biomedical photoacoustic imaging[J].Interface Focus, 2011, 1(4):602-631. doi: 10.1098/rsfs.2011.0028 [25] GU H M, YANG S H, XIANG L Z. Photoacoustic tomography and applications in the medical clinic diagnosis[J]. Progress in Biochemistry and Biophysics, 2006, 33(5):431-437(in Chinese). [26] QIAN S Y, XING D. Research progress in image of biological tissues combining light and sound[J]. Acta Laser Biology Sinica, 2000, 9(3):228-231. [27] MIAO S F, YANG H, HUANG Y H, et al. Research progresses of photoacoustic imaging[J]. Chinese Optics, 2015, 8(5):699-713(in Chinese). doi: 10.3788/co. [28] XU M, WANG L V. Photoacoustic imaging in biomedicine[J].Review of Scientific Instruments, 2006, 77(4):041101. doi: 10.1063/1.2195024 [29] GUSEV V E. Laser optoacoustics[M]. New York, USA:American Institute of Physics, 1991:93-271. [30] VOGEL A, VENUGOPALAN V. Mechanisms of pulsed laser ablation of biological tissues[J]. Chemical Reviews, 2003, 103(2):577-644. doi: 10.1021/cr010379n [31] AMERICAN NATIONAL STANDARDS INSTITUTE. American national standard for the safe use of lasers[M]. New York, USA:American National Standards Institute, 2000:1-10. [32] WON N, JEONG S, KIM K, et al. Imaging depths of near-infrared quantum dots in first and second optical windows[J]. Molecular Imaging, 2011, 11(5):1-2. [33] YARIV A. Quantum electronics[M]. 3rd ed.New York, USA:Wiley, 1989:169-199. [34] KOECHNER W. Solid-state laser engineering[M]. 6rd ed. New York, USA:Springer Verlag, 2006:342-411. [35] SU J S, WANG B, EMELIANOV S Y. Photoacoustic imaging of coronary artery stents[J].Optics Express, 2009, 17(22):19894-19901. doi: 10.1364/OE.17.019894 [36] LAUFER J, ELWELL C, DELPY D, et al. In vitro measurements of absolute blood oxygen saturation using pulsed near-infrared photoacoustic spectroscopy:accuracy and resolution[J]. Physics in Medicine and Biology, 2005, 50(18):4409-4409. doi: 10.1088/0031-9155/50/18/011 [37] AGARWAL A, HUANG S, O'DONNELL M, et al. Targeted gold nanorod contrast agent for prostate cancer detection by photoacoustic imaging[J]. Journal of Applied Physics, 2007, 102(6):064701. doi: 10.1063/1.2777127 [38] SETHURAMAN S, AMIRIAN J H, LITOVSKY S H, et al. Spectroscopic intravascular photoacoustic imaging to differentiate atherosclerotic plaques[J].Optics Express, 2008, 16(5):3362-3367. doi: 10.1364/OE.16.003362 [39] KOLKMAN R M, STEENBERGEN W, van LEEUWEN T G. In vivo photoacoustic imaging of blood vessels with a pulsed laser diode[J].Lasers in Medical Science, 2006, 21(3):134-139. doi: 10.1007/s10103-006-0384-z [40] SU S Y, LI P C. Coded excitation for photoacoustic imaging using a high-speed diode laser[J]. Optics Express, 2011, 19(2):1174-1182. doi: 10.1364/OE.19.001174 [41] ALLEN T J, BEARD P C. High power visible light emitting diodes as pulsed excitation sources for biomedical photoacoustics[J]. Biomedical Optics Express, 2016, 7(4):1260-1270. doi: 10.1364/BOE.7.001260 [42] ALLEN T J, BEARD P C. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging[J]. Optics Letters, 2006, 31(23):3462-3464. doi: 10.1364/OL.31.003462 [43] ALLEN T J, BEARD P C. Dual wavelength laser diode excitation source for 2-D photoacoustic imaging[J]. Proceedings of the SPIE, 2007, 6437:64371U. doi: 10.1117/12.698651 [44] DAOUDI K, VAN P, RABOT O, et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging[J]. Optics Express, 2014, 22(21):26365-26374. doi: 10.1364/OE.22.026365 [45] UPPUTURI P K, PRAMANIK M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system[J]. Biomedical Optics Express, 2015, 6(10):4118-4129. doi: 10.1364/BOE.6.004118 [46] ZENG L, PIAO Z, HUANG S, et al. A practical optical-resolution photoacoustic microscopy prototype using a 300mW visible laser diode[J]. Proceedings of the SPIE, 2016, 9708:97084T. doi: 10.1117/12.2209201 [47] ZENG L, PIAO Z, HUANG S, et al. Label-free optical-resolution photoacoustic microscopy of superficial microvasculature using a compact visible laser diode excitation[J]. Optics Express, 2015, 23(24):31026-31033. doi: 10.1364/OE.23.031026 [48] HOSHIMIYA T. Closed/open-cell photoacoustic imaging for spectroscopic measurements[J]. Journal of Applied Mathematics and Physics, 2016, 4(8):1470-1474. doi: 10.4236/jamp.2016.48152 [49] AGANO T, SATO N, NAKATSUKA H, et al. Comparative experiments of photoacoustic system using laser light source and LED array light source[J]. Proceedings of the SPIE, 2015, 9323:93233X. doi: 10.1117/12.2077357 [50] AGANO T, SATO N. Photoacoustic imaging system using LED light source[J]. Optical Society of America Publishing, 2016, ATh3N:ATh3N.5. [51] AGANO T, SATO N, NAKATSUKA H, et al. Attempts to increase penetration of photoacoustic system using LED array light souce[J]. Proceedings of the SPIE, 2015, 9323:93233Z. doi: 10.1117/12.2077377 [52] AGANO T, SATO N, NAKATSUKA H, et al. Photoacoustic imaging of clinical metal needle by a LED light source integrated transducer[J]. Proceedings of the SPIE, 2016, 9708:97083U. doi: 10.1117/12.2212685 -

 网站地图
网站地图

 下载:
下载:



