HTML
-
元素成像技术的发展,让人们对微观元素世界有了更深的了解。特定元素的原位可视化在生物学、地质学、考古学等领域中扮演着重要角色。通过对元素及其化合物的空间分布探测,使得人们对物质的演化过程有了更深层次的理解。
目前,应用于元素检测技术的方法有很多种[1], 常用的元素成像技术主要依托于以下3种方法:(1)金属探针方法,如电子探针显微分析仪(electron probe micro-analyzer, EPMA)、二次离子质谱(secondary ion mass spectroscopy, SIMS)探针等[2-3];(2)质谱检测方法,如电感耦合等离子体质谱(inductively coupled plasma-mass spectroscopy, ICP-MS)技术、激光剥蚀电感耦合等离子体质谱(laser ablation-inductively coupled plasma-mass spectroscopy, LA-ICP-MS)法等[4];(3)辐射方法,如同步辐射X射线荧光成像(synchrotron radiation X-ray fluorescence, SRXRF)技术、粒子诱导X射线发射(particle-induced X-ray emission, PIXE)、透射电镜-能量弥散X射线(transmission electron microscope-energy dispersive X-ray, TEM-EDX)光谱等[5-8]。这些方法的空间分辨率都达到了微米级别,其中,TEM-EDX的空间分辨率更是达到纳米级别。EPMA可进行现场采样分析,结合显微镜能够实现元素成像,但其耗时过长、检测极限低,价格非常昂贵;TEM-EDX和PIXE有着较高的检测极限,但是应用范围较窄,样本制备过程繁琐;SRXRF有着不错的分辨率及检测极限,但是元素检测的过程耗时过长,价格昂贵;LA-ICP-MS在应用及元素检测能力方面都有不错的表现,但是对生物样本中的常见元素如碳(H)、氮(N)、氧(O)、氯(Cl)测量的精度不高,以及其需要严格的环境。
近些年,一种基于激光诱导击穿光谱技术(laser-induced breakdown spectroscopy,LIBS)的元素成像技术倍受关注,该技术能够实现样品元素空间分布成像;且得益于LIBS在元素检测方面的优势,该成像技术无需复杂的样本制备过程,样本大小不受限制,空间分辨率高,可以达到10-6量级的灵敏度,分析速度能达到约100Hz,几乎是其它分析技术的10倍~100倍,且对分析环境要求较低。得益于以上优点,使它成为一种非常有应用前景的检测技术,在古气候研究、生物医学、工业生产、环境检测等领域都有不错的发展,尤其是药物代谢及生物组织的病理分析等应用。
-
激光诱导击穿光谱技术是一种原子发射光谱技术,是物质分析领域中最便捷和快速的分析技术之一。高能脉冲激光光束聚焦于样本表面,激发产生等离子体,等离子体在喷射过程中快速冷却,处于激发态的原子或离子返回基态,最后发出特定光信号[9]。LIBS技术具有检测迅速[10]、多元素定性定量分析[11-12]、样本制备方便、样本多态分析、原位监测[13]等诸多优点。LIBS技术广泛应用于不同的领域[14],如工业生产、核聚变装置监测、地质样本检测、环境污染检测、生物医学等[15-20]。
近几十年,LIBS技术的发展主要集中在光谱信号的提升、元素分析方法改进、应用的拓展等方面。维持稳定且强度较高的光谱信号对微量元素的光谱信息提取是至关重要的,相应的方法如信号探测器的升级、环境气体的改变、稳定磁场的加入等方法。常用的LIBS光谱分析方法包括定性与定量分析。光谱强度的对比是一种普遍的定性分析方式,在多数实践中,对谱线的相似及不同之处进行比较的应用场景包括:(1)监测样本频谱的差异性;(2)样本的分类;(3)通过数据库识别样本等。常见的定性分析方法有主成分分析(principal component analysis, PCA)[21]、偏最小二乘法判别分析(partial least squares-discrimination analysis, PLS-DA)[22]。常见的定量分析方法有多元线性回归(multi-liner regression,MLR)、偏最小二乘法(partial least squares, PLS)。另外,神经网络(artificial neural network, ANN)也适用于定性与定量分析[23]。
-
LIBS成像技术是基于LIBS技术获取样本表面不同位置的主要(微量)元素的光谱强度数据,然后结合不同波长的光谱强度信息以及对应的位置信息进行定性定量分析,最后通过伪彩图呈现出区域间元素分布的差异性。该成像技术的前端光路工作原理与LIBS相似,都是聚焦光束轰击目标样本表面并采集光谱,而LIBS成像技术的特点是:(1)激光器、光谱仪、电动位移装置之间高速协同工作,该成像技术需要三者按时序协同运转且对三者运行的速度要求较高,频率一般在10Hz~100Hz之间;(2)空间分辨率高,该成像技术对分辨率的要求较高,而空间分辨率的提高需要更小的聚焦光斑尺寸,一般小于50μm;(3)数据快速存取技术,由于每幅光谱所含的数据较多,且采集频率较高,需要更快的数据存取技术将采集的数据保存并分析;(4)元素光谱数据可视化,该技术通过伪彩图的方式呈现出样本表面元素分布情况。
传统LIBS技术对采集光谱的数量要求较少、采集速度要求较低、且需要分析的样本表面分布较均匀以减少测量误差,而LIBS成像技术则是需要检测出样本中元素分布的差异性。如果说传统的LIBS技术分析的是“点”;那么,LIBS成像技术分析的则是“面”。与其它成像技术相比,LIBS成像技术在采集速度、工作环境的需求、样本制备、应用范围方面都有一定的优势。
-
在较高的空间分辨率下的LIBS成像技术需要完成约10000组左右的光谱数据采集,因此需要缩短采集的周期。该过程的实现需要激光器、光谱仪、电动位移装置及光谱数据处理软件之间高速协同运行,因此,对整体硬件的要求相对较高,同时硬件间协同运行需要软件的开发,多数研究人员采用LabVIEW开发相应的软件控制整套系统去实现样本按照规划路线快速的运动,以及激光器和光谱仪的时序同步。
激光源的大小目前应用于元素成像系统的激光器多为红外(紫外)固体激光器、准分子激光器。虽然在相同激光功率密度下,波长越长,其电子温度及电子强度越强,光谱强度相对较高,有利于微量元素信号的检测,但是,红外光源对等离子体的激发多由于光热作用,对于生物组织,热效应会损害光束轰击区域周边的细胞活性,因此,对生物组织的检测主要是利用紫外波段光源。相同条件下,波长越短,空间分辨率越高。另外,有实验室利用飞秒激光器应用于特定样本分析,如BELLO等人利用飞秒脉冲激光检测牙齿中汞合金的扩散深度[24]。
LIBS成像技术空间分辨率的提高同样依赖于光路聚焦系统。研究者大多采用15倍聚焦透镜,高倍聚焦镜头有助于提高空间分辨率,已报道的光斑直径在7μm~50μm范围内,空间分辨率控制在10μm~100μm之间。而且,LIBS成像技术对光谱信号的要求也高。惰性气体的加入有助于提高减少光路中激光能量的损耗和光谱信号的稳定性,绝大多数相关实验中都会用到氩气(Ar)、氦气(He)等稳定性气体,法国里昂大学的SANCEY实验小组对聚焦光路及样本台中通入Ar,有效地提高了谱线信噪比[25]。
光谱仪的3个重要参量是:谱线范围、分辨率、积分时间。谱线范围定义了LIBS检测的度量能力,LIBS分析的主要元素相关的原子发射光谱范围在190nm~850nm。分辨率决定了光谱图分析电磁波谱中的特征,分辨能力R=λ/Δλ(λ为波长,Δλ为λ处的线宽),LIBS成像系统常用的光谱仪为Paschen-Runge光谱仪、Czerny-Turner光谱仪,并且配备增强型电荷耦合器件(intensified charge coupled device, ICCD),对检测极限的提高及高速扫描都有一定的作用。
对于面积较大的地质样本,维持每个像素点的激光能量的一致性是必要的,西班牙马德里孔普鲁顿大学的CACERES研究小组通过自动聚焦系统维持聚焦镜头与样本表面每个像素点的恒定距离[26]。
在LIBS成像技术中,激光源(波长、脉冲能量、稳定性)、光路系统及光谱仪对空间分辨率和检测灵敏度都有重要影响,考虑到样本类型、扫描区域的大小、成像的空间分辨率、检测的灵敏度以及时间等因素,研究人员可以结合各仪器以满足实验需要。表 1中回顾了几种常见的激光器、聚焦光路、光谱仪等类型及空间分辨率和检测限。
激光器
(波长,脉宽,频率)光谱仪 光路聚焦系统 空间分辨率/检测限 参考文献 四倍频Nd:YAG激光器
(266nm,10Hz)Czerny-Turner型光谱仪CCD 15倍放大物镜 10μm/(2μg/g~16μg/g) [25] Nd:YAG激光器
(1064nm, 5ns, 100Hz)双Czerny-Turner型光谱仪ICCD 15倍放大物镜 10μm/(5μg/g~7μg/g) [26] 二倍频钛蓝宝石飞秒激光器
(400nm, 175fs, 1kHz)Echelle型光谱仪ICCD 两种不同焦距的透镜组合
(焦距f1=9.0mm,焦距f2=15.0mm)6μm/— [27] 四倍频Nd:YAG激光器
(266nm,2Hz)Czerny-Turner型光谱仪CCD 40μm/— [28] 四倍频Nd:YAG激光器
(266nm);
Nd:YAG激光器(1064nm)(正交)Czerny-Turner型光谱仪ICCD 常规聚焦透镜(焦距f=80mm) 50μm/(39μg/g~78μg/g) [29] Nd:YAG激光器
(1064nm, 10ns)Czerny-Turner型光谱仪ICCD 石英透镜(焦距f=28mm) 90μm/(100μg/g) [30] Nd:YAG激光器(1064nm, 5ns, 10Hz) Maya 2000Pro型光谱仪CCD 15倍放大物镜 10μm/(2mg/g) [31]
-
虽然LIBS技术已经发展多年,但是LIBS扫描成像技术的应用时间较短,凭借其诸多优势,在古气候研究、人体病理研究、药物代谢研究、植物组织研究等领域都有广泛的应用。
-
LIBS技术很早就应用于地质样本的考古研究中,但是,对于样本的区域性元素分析报道较少。为了研究古代气候的变化,如降水情况、地球重大气候变化、生物生长过程变化等,已有报道基于元素分布成像技术从化石样本中提取到有参考性的古气候数据。
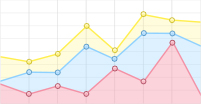
海洋软体动物外壳中的碳酸钙及微量元素为海洋地表温度、盐度及污染等环境分析提供了非常有价值的数据信息。环境变化与元素变化有着高度相关性,并且依赖当地环境和内生机制,通过基于稳定同位素(13C, 15N, 18O)的碳酸钙或者微量元素镁钙比(Mg/Ca)、锶钙比(Sr/Ca)、锶镁比(Sr/Mg)分析软体生物的生长情况。贝壳和珊瑚石是研究海洋气候中的代表生物。2017年,英国约克大学的HANSMANN研究小组利用元素成像技术快速分析3种不同贝壳外壳样本中的Mg/Ca光谱强度比值[30]。3种不同样本分别取自欧洲牡蛎(Ostrea edulis,1758年)、突畸心蛤(Anomalocardia flexuosa,1767年)、凤凰螺(Conomurex fasciatus,1778年)生长方向上部分位置,通过环氧树脂对样本进行固定,用低速切割机对表面进行抛光处理。扫描的空间分辨率较高,为90μm左右,每小时采集光谱数据20000组。该实验小组对3组样本同时采用了面扫描及线扫描(沿着生长方向)两种方法,图 1a、图 1c、图 1e是该实验的伪彩图,图 1b、图 1d、图 1f为生长方向上线扫描的Mg/Ca变化。从图中可以看出, 3种不同生物都有非常明显的层状分布现象,这些是由于季节性环境变化导致的。通过对Mg/Ca等光谱强度比值IMg/ICa的分析,能够了解贝壳所处环境的季节变化。
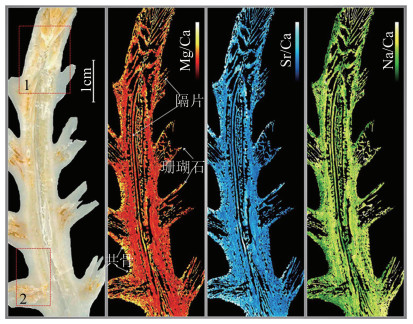
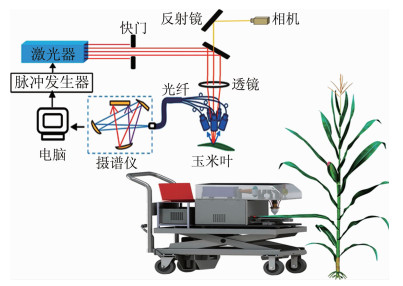
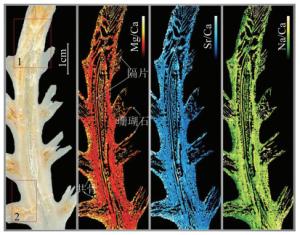
从面积约为10mm2的大型地质样本表面提取百万级像素的元素数据一直是分析技术领域的难题。2017年,西班牙马德里孔普鲁顿大学的CACERES研究小组实现了对大面积珊瑚石样本的元素扫描[26]。该研究小组在分辨率、检测灵敏度和运行速度上有显著提升,将样本的空间分辨率提升至10μm;检测灵敏度为10-6;且拥有100Hz的扫描速度,是其它元素成像技术的10倍左右,同时将大型地质样本的元素成像技术首次提升至百万级像素。文中指出影响分析速度的主要因素主要有以下两点:(1)激光器的重频;(2)探测器的采集速率。目前,固体激光器的长脉冲可以实现MHz的频率,并且有报道探测器的采集速率能达到1kHz,这些优势赋予LIBS扫描技术在宏观样本上分析微观元素的能力。图 2是珊瑚石中元素在不同部位的分布图。高浓度的Mg、Sr元素多分布于珊瑚石的边缘及分支,而Na元素多分布于珊瑚石的躯干中心部分,且树状珊瑚石的根部元素浓度高于顶部。
-
元素在生物组织内的分布情况是病理诊断及治疗的重要信息来源。金属元素的迁移、储存及分配等生物机制的检测是疾病快速识别与诊断的重要手段。细胞中化学元素的失调可能导致一系列的疾病发生。针对人体病理分析,LIBS成像技术在该领域也能充分展现其快速的病理(尤其是癌症)诊断能力,展示了巨大的应用前景。
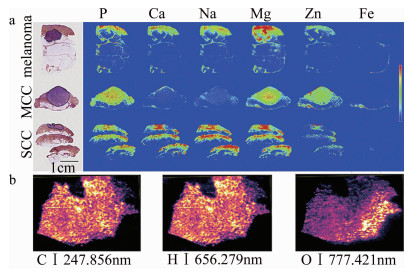
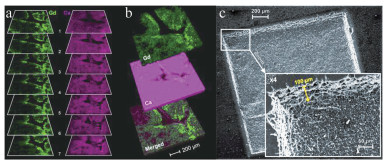
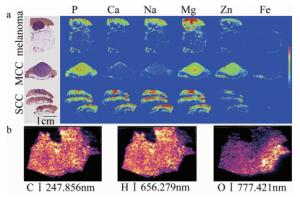
2017年,法国里昂大学的MONCAYO等人利用LIBS成像系统分析石蜡嵌入的人体皮肤活检,包括健康的皮肤,带有黑色素瘤、默克尔细胞癌和鳞状细胞癌的病态皮肤[32]。通过实验,分别检测了金属及非金属元素,发现了不同肿瘤皮肤下元素空间分布的差异性及强弱分布情况,并且利用苏木精伊红藏红染色剂(hematoxylin-eosin staining, HES)对4种不同的皮肤进行染色处理以便与LIBS成像技术比较,两者共同呈现了组织中癌变区域与健康区域之间的明显界限。该实验小组实现了对皮肤组织3个生理层(表皮、真皮、皮下组织等)的元素识别及可视化,并与HES染色的皮肤组织进行对比分析,如图 3a所示。结果表明,肿瘤与周围非肿瘤区域之间,钠(Na)、镁(Mg)、钙(Ca)、锌(Zn)等元素的分布和含量都不同,在与病理相关的生理区域内,部分元素的存在与缺失带来了超越视觉的组织病理学信息。
2017年,法国高等生物科学研究所的BUSSER等人通过LIBS成像技术研究了对皮肤、淋巴、肺部组织中由于术后操作不规范导致的外源性物质的分析检测[33]。该实验小组采用了淋巴细胞或者含有颗粒等皮肤组织的炎症细胞,定位识别分析了如皮肤肉芽肿瘤和皮肤假性淋巴癌中的铝、钛、铜和钨等外生元素。2016年,奥地利维也纳化学技术与分析研究所的BONTA等人利用LIBS成像技术对人体肿瘤组织中主要成分元素碳(C)、氢(H)、氧(O)、钠(Na)、钾(K)的分布情况进行了研究[28],如图 3b所示,通过微量元素(如P与O的分布对比),发现了如磷酸盐等化合物的高浓度区域,对抗癌药物的开发及疗效验证有很大的帮助。
-
纳米药物的发展在药物代谢领域展现了巨大的潜力,包括器官成像技术、药物治疗等,纳米技术有望彻底解决诊断、基因治疗、药物运输等技术难题,因此,研究它们在器官中的吸收及代谢特性十分重要,但是由于其体积较小,常规的标记检测方式如荧光标记等,可能会改变它们的形状,大小及电荷分布,甚至改变它们的生物特性,且荧光标记技术不稳定,容易丢失部分粒子的分布,导致不能真实显示器官中纳米粒子的分布。目前,越来越多的研究人员利用LIBS成像技术实现了对器官中不同时间段内的纳米材料的空间分布呈现。
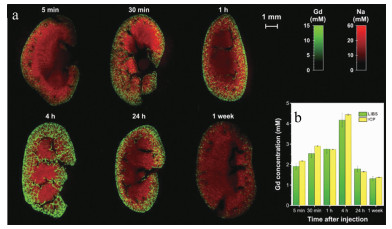
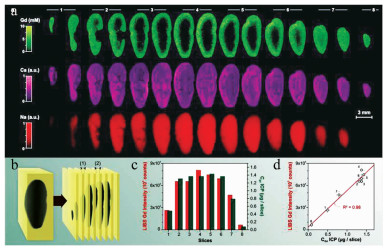
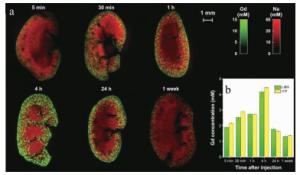
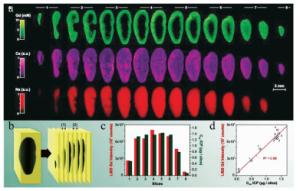
2014年,法国里昂大学的SANCEY等人利用基于镉(Gd)和硅(Si)元素的纳米材料注入实验小鼠体内[25],如图 4所示,并且通过LIBS成像技术分析了不同时间段的小鼠肾脏内部平面上纳米材料Gd, Si及肾脏内含元素铁(Fe)、钠(Na)的分布成像,空间分辨率为10μm。图 5展示了利用TCP-MS辅助验证LIBS成像技术结果。从图 5中可以看出,纳米材料所含元素在肾脏中的含量呈现先增后减的过程(4h时Gd, Si信号最强)该实验小组通过LIBS技术实现了纳米材料在载体中的成像分析,并且能够实时跟踪目标元素的代谢过程和动力学分析,为纳米药物的临床分析提供了可靠的数据分析。2016年,GIMENEZ等人首次利用两种互补的成像方法共同实现了小鼠肾脏内纳米材料的3维无标签成像,弥补了器官中元素2维成像的纵向解析不足等缺点[34]。该实验方法1如图 6所示:将小鼠肾脏器官纵向切片(厚度200μm左右)多组,并分析每组切片双面元素分布,然后将LIBS图像叠加在3维图像中,为Gd, Na, Ca构建覆盖整个器官的3维模型图,通过这些模型绘制出了任何深度及横向方向上的3维图(空间分辨率为35μm)。实验方法2如图 7所示:通过同一区域内激光多次剥蚀,剥蚀深度总共为500μm(空间分辨率为10μm左右)。由两种方法的互补效应更加精准地从3维分析小鼠肾脏中纳米材料的代谢过程,特别是在肾髓中对纳米材料的深度分析。
-
LIBS成像技术也能监测植物样本所处的环境及生长情况,包括检测相关元素(这些元素包括营养元素、有毒元素)的摄取、运输和积累等分布情况,对了解植物样本的生长情况、所处环境的优劣、植物与环境之间的相互作用,都是非常有意义的。
2016年,中国国家农业信息技术研究中心的ZHAO等人研制出能够在现场检测活体植物和土壤中多元素分布的元素映射系统[35], 如图 8所示。该系统可以研究植物中营养成分和有害元素的分布,以及植物与环境之间的相互作用。该系统的空间分辨率为200μm,且可以通过数据处理软件能够得到植物中农药的存在与浓度信息。2017年,捷克Masaryk大学的KRAJCAROVA等人通过LIBS成像技术实现了蚕豆根部中金属离子和纳米材料的分布成像[29]。该实验配置了双脉冲激光(266nm,1064nm激光器,激光正交)。蚕豆根部被置于10μmol/L的硫酸铜/硝酸银溶液(CuSO4/AgNO3)或银纳米晶溶液(AgNPs)中后,并对根部固化切片处理(约40μm)。该实验中发现了植物根部对金属元素的吸收特性, 并为LIBS成像技术在植物学和生态毒理学中的发展提供了可靠的信息。
-
2017年,奥地利开普勒大学的AHAMER等人首次利用飞秒脉冲激光实现了薄膜的LIBS扫描成像[27]。该实验小组分别用了铜(Cu)膜和钇钡铜氧(yttrium barium copper oxide, YBCO)薄膜,两种薄膜的厚度分别在5nm~500nm和200nm~1000nm范围内。该实验中将薄膜成像的空间分辨率提升至6μm,且将LIBS成像的应用拓展至纳米级厚度薄膜。2017年,法国里昂大学的TRICHARD等人实现了矿物质中在真空紫外波段(150nm~200nm)的硫(S)等15种元素的LIBS成像,为矿物质样本的元素识别及特征提取提供了重要的途径[31]。2017年,捷克中欧技术学院的SKARKOVA等人通过对量子点的2维LIBS成像,避免了部分因实验环境(如pH值等)造成的不发光量子点的遗漏,展现了LIBS成像技术成为一种新型荧光检测方法的巨大潜力[36]。
4.1. 古气候研究
4.2. 人体病理研究
4.3. 药物代谢研究
4.4. 植物组织研究
4.5. 其它应用
-
LIBS成像技术是一种具有广泛应用前景的元素分析技术,且LIBS成像技术在古气候研究、生物医学、临床等领域展现了巨大的应用前景。LIBS成像技术能够现场检测、原位检测、3维空间检测,且样本制备相对简易,对柔软的生物样本只需通过固化等处理,与一般的生物制样方法无多大差别。目前,LIBS成像技术的自动化程度相对较高,能够同时实现微区及大面积尺寸的样本扫描成像。实现LIBS成像需要维持空间分辨率和检测灵敏度及检测限之间的平衡关系和提高扫描及光谱采集与存储的速度。未来应该增加定量分析的方法,如利用自由定标法,以及与ICP-MS/OES、光学显微镜的联用等。该技术目前正在进入一个崭新的时代,越来越多的实验室将其作为一种新型检测技术。目前LIBS成像仪器处于研究阶段,相信随着科技的发展,该技术未来一定会往商业化方向发展,且能够扩展更多的应用。但是,不可否认的是,其对样本的侵入性会限制它在诸如人体等活体中的检测。国外在LIBS成像领域取得不错的研究成果,而国内LIBS成像技术的报道较少,且成像的空间分辨率相对较低,在100μm~500μm左右。

 Map
Map

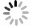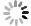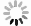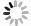




 DownLoad:
DownLoad: